IgAN-Ursachen
In den letzten Jahrzehnten kristallisierte sich immer mehr heraus, dass der Darm ein vielseitiges, multifunktionelles Organ ist, das nicht nur Nahrungsmittel zur Verwertung der Nährstoffe verarbeitet. Der Darm steht in Verbindung zu anderen Organen und kann unter anderem auch die Nieren beeinflussen. Außerdem dient er als wichtige Barriere zum Schutz vor Krankheitserregern und Toxinen.1 Die Darmschleimhaut ist ständig Nahrungsantigenen und Bakterien ausgesetzt.2 Daher ist es für uns unerlässlich, dass die Immunzellen der Darmschleimhaut diese potenziellen Fremdkörper unter Kontrolle halten. Hierfür besitzt der Darm ein eigenes Immunsystem, zu dem auch das darmassoziierte lymphatische Gewebe, oder kurz GALT, zählt. Zum GALT gehören auch die sogenannten Peyer-Plaques im Dünndarm, eine Ansammlung von Lymphfollikeln, die sich im distalen Ileum (letzter Teil des Dünndarms) konzentrieren. Dort wird durch Antigenkontakt die Bildung IgA1-produzierender Plasmazellen angeregt. Das dort gebildete IgA1 wird als mukosales IgA1 bezeichnet und hat charakteristische Merkmale, die diese Antikörper von anderen IgA1-Formen unterscheiden.3
Was ist so besonders an IgA1?
Immunglobulin A kommt generell als Serum-IgA und als sekretorisches IgA vor. Das im Blutserum zirkulierende IgA wird hauptsächlich im Knochenmark synthetisiert (als Teil des körpereigenen Abwehrsystems) und besitzt eine monomere Struktur.4 Außerdem zeichnet es sich durch charakteristische Galaktosereste an der Gelenkregion aus und wird von der Leber verstoffwechselt.5 Sekretorisches IgA liegt hingegen als Dimer vor und wird aus den Schleimhäuten der Atemwege und des Darms freigesetzt.3 Darüber hinaus werden humane IgA-Antikörper weiterhin in zwei Unterklassen unterteilt, IgA1 und IgA2.3, 4
Bei der pathophysiologischen Entstehung der IgA-Nephropathie scheint vor allem IgA1, das in den Peyer-Plaques der Dünndarmschleimhaut gebildet wird, eine wichtige Rolle zu spielen. Diese spezielle Isoform des IgA1-Antikörpers unterscheidet sich jedoch strukturell von dem, das im Serum zirkuliert, denn es zeichnet sich durch einen Mangel an Galaktoseresten in der Gelenkregion aus und wird deshalb auch als galaktosedefizientes IgA1 bezeichnet (gd-IgA1).3, 4
Galaktosedefizientes IgA1: ein komplexes Molekül mit einer „offenen“ Gelenkregion für Autoantikörper
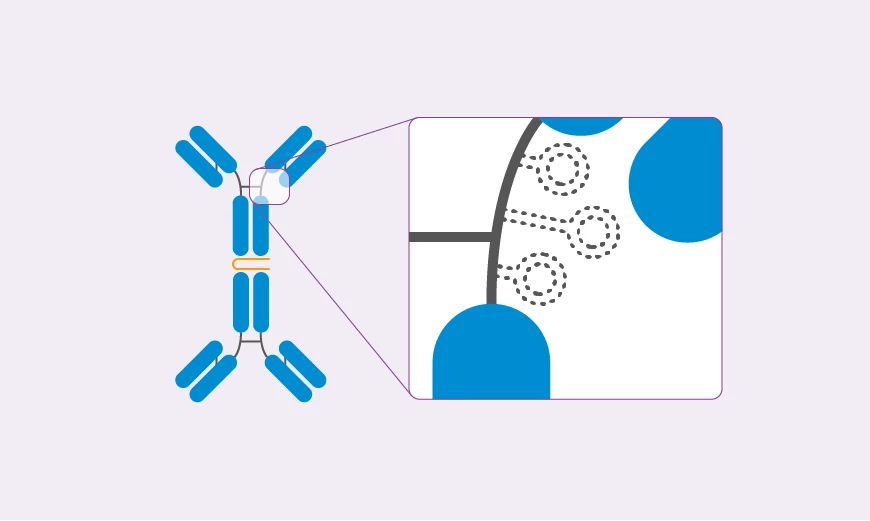
Pathophysiologische Phasen der IgA-Nephropathie
In der Regel gelangen nur geringe Mengen des galaktosedefizienten IgA1 in den systemischen Blutkreislauf. Bei Betroffenen mit IgAN passiert jedoch genau das Gegenteil:
Größere Mengen des galaktosedefizienten IgA1 aus dem Darm gelangen in systemische Zirkulation. Dies löst eine Immunreaktion aus, da es im Blut anhand der Galaktosedefizienz als fremd erkannt wird.6 Auf diese Weise werden IgA- und IgG-Autoantikörper aktiviert und binden an die offene Gelenkregion des IgA1-Moleküls. So bilden sich pathogene Immunkomplexe, die sich dann im glomerulären Mesangium der Niere ablagern. Diese Komplexe können im weiteren Verlauf zu einer Aktivierung des Komplementsystems führen, gefolgt von Entzündungen, Schädigungen und einer damit einhergehenden Verschlechterung der Nierenfunktion.3, 4, 6 Somit kann galaktosedefizientes IgA1, das physiologisch nicht in den Blutkreislauf gelangen sollte, die primäre Ursache für die Glomerulonephritis sein.
Diese Einblicke in die Pathophysiologie der IgA-Nephropathie eröffnen völlig neue Möglichkeiten für Behandlungsstrategien, die gezielt auf die ursprüngliche Ursache abzielen.7, 8
Der pathophysiologische Verlauf einer IgAN
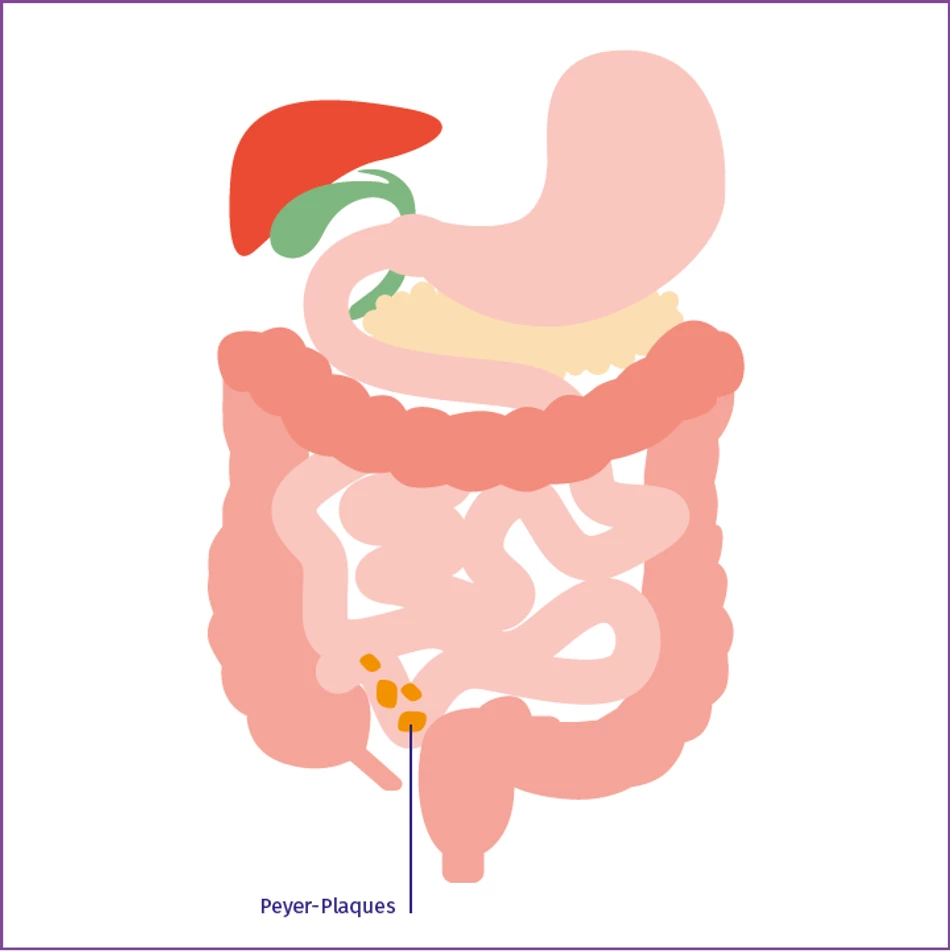
Peyer-Plaques
Peyer-Plaques
Peyer-Plaques im distalen Ileum erzeugen IgA in der Schleimhaut.
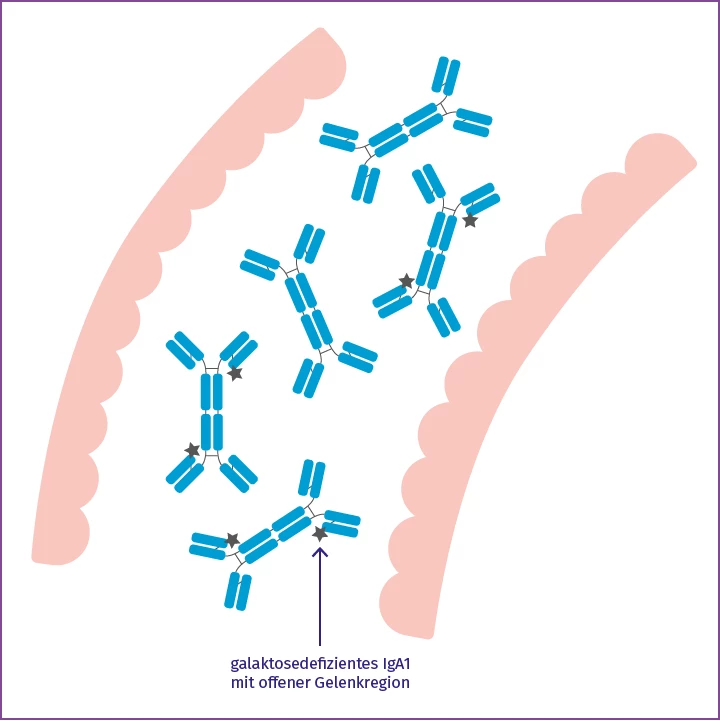
Galaktosedefizientes IgA1
Galaktosedefizientes IgA1
Ein Teil dieses IgA ist galaktosedefizientes IgA1 mit einer offenen Gelenkregion.
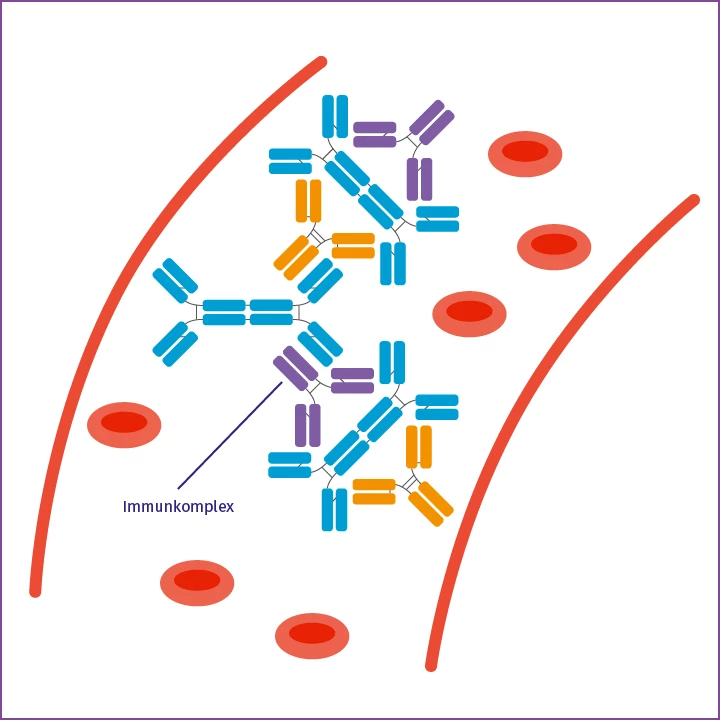
Identifizierung durch das Immunsystem
Identifizierung durch das Immunsystem
Gelangt dieses galaktosedefiziente IgA1 in den Blutkreislauf, wird es vom Immunsystem identifiziert und durch Autoantikörper gebunden.
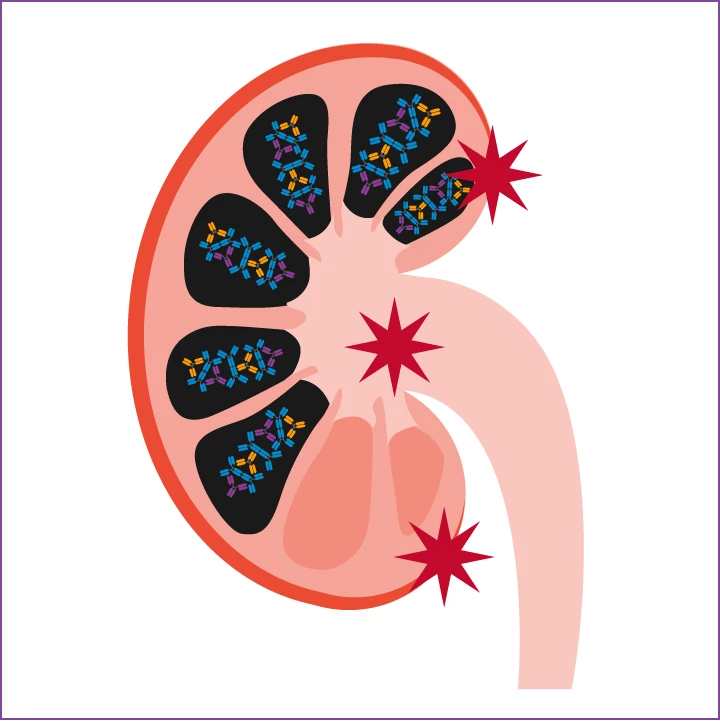
IgA-Nephropathie
IgA-Nephropathie
Die daraus entstehenden pathogenen Immunkomplexe lagern sich im glomerulären Mesangium ab, was schließlich zur Ausbildung einer IgA-Nephropathie führen kann.
Eine hohe Rezidivrate nach Nierentransplantationen spricht für einen extrarenalen Ursprung der IgAN
Der Verdacht auf einen extrarenalen Ursprung dieserNephropathiewird durch die hohenRezidivraten nach eigentlich erfolgreichen Nierentransplantationen bestätigt:
In der Vergangenheit entschied man sich zur Behandlung von Menschen mit Nierenversagen im Endstadium vorrangig für eine Nierentransplantation. Allerdings tritt bei etwa 33% der Betroffenen ein Rezidiv der IgA-Nephropathie auf. Dieses Rezidiv kann bereits unmittelbar nach der Transplantation auftreten, im Schnitt wird es jedoch etwa 3 Jahre nach der Transplantation diagnostiziert.9 Insbesondere, wenn der IgA-Serumspiegel innerhalb eines Jahres nach der Transplantation ansteigt, besteht ein hohes Risiko für das erneute Auftreten einer IgA-Nephropathie. 10
Erfahren Sie mehr über IgAN
Referenzen
- Ahlawat S et al. Gut-organ axis: a microbial outreach and networking. Lett Appl Microbiol 2021; 72(6): 636–668.
- Kinashi Y, Hase K. Partners in Leaky Gut Syndrome: Intestinal Dysbiosis and Autoimmunity. Front Immunol 2021; 12: 673708.
- Barratt J et al. Why Target the Gut to Treat IgA Nephropathy? Kidney Int Rep 2020; 5(20): 1620–1624.
- He JW et al. Perspectives on how mucosal immune responses, infections and gut microbiome shape IgA nephropathy and future therapies. Theranostics 2020; 10(25): 11462–11478.
- Thaiss F, Stahl RAK. IgA-Nephropathie. Klinik, Pathogenese und Therapie der häufigsten Glomerulonephritis. Dt Ärztebl 2000; 97(41): A 2708–2711.
- Stanley JC et al. Progress in pathogenesis of immunoglobin A nephropathy. Cureus 2020; 12(6): e8789.
- Papista C, Berthelot L, Monteiro RC. Dysfunctions of the Iga system: a common link between intestinal and renal diseases. Cell Mol Immunol 2011; 8(2):126–134.
- Selvaskandan H et al. New strategies and perspectives on managing IgA nephropathy. Clin Exp Nephrol 2019; 23(5): 577–588.
- Ponticelli C, Glassock RJ. Posttransplant recurrence of primary glomerulonephritis. Clin J Am Soc Nephrol 2010; 5(12): 2363–2372.
- Garnier AS et al. Early post-transplant serum IgA level is associated with IgA nephropathy recurrence after kidney transplantation. PLoS One 2018; 13(4): e0196101.







